- 石榴说
- 健康资讯
恶性肿瘤微量营养素缺乏与补充专家共识
None
日期:2024-10-21作者:来源:医学界肿瘤频道

摘 要
微量营养素即微量元素和维生素,是人体需求量少,但维持机体正常生理功能所必需的物质。恶性肿瘤是当今世界面临的重大挑战之一,作为一种慢性消耗性疾病,是营养不良的高危人群,中国抗癌协会肿瘤营养专业委员会2019年报告显示,我国肿瘤患者营养不良发生率高达58%。尽管针对恶性肿瘤患者给予适当的营养治疗已获普遍认可,但微量营养素作为营养物质的一部分,在恶性肿瘤患者中的重要性尚未引起广泛重视。微量营养素的缺乏会影响肿瘤的发生、发展,使患者抗肿瘤治疗耐受性下降,不良反应增加,对生活质量产生负面影响,缩短患者生存期。由于肿瘤类型、治疗方案和个体差异等因素的存在,微量营养素补充的实践存在许多争议和不确定性,因此,本共识组织医疗、营养、护理三方人员形成跨学科协作,基于现有的国内外研究和证据,详细阐述了微量营养素缺乏对恶性肿瘤患者的影响,并就恶性肿瘤患者微量营养素的测定、评价及补充治疗等做总结和推荐,以满足微量营养素的营养需求。
关键词:微量营养素;恶性肿瘤;营养治疗;共识正 文
微量营养素(micronutrients,MNs)是人体含量少但必需的营养物质,是机体有效利用葡萄糖、脂肪供能及合成蛋白质的基础[1]。微量营养素失衡与肿瘤密切相关,其缺乏可促进肿瘤发生、发展[2-3],降低肿瘤治疗的敏感性[4],加重治疗相关不良反应等[5]。恶性肿瘤患者由于肿瘤本身及手术、放化疗等相关不良反应导致机体摄取、利用食物障碍[6],同时部分患者处于高代谢状态,常合并局部或全身炎症反应,对营养物质尤其是微量元素的需求明显增加[7]。因此,患者常常容易出现微量营养素缺乏,进而影响治疗效果及机体恢复。对恶性肿瘤患者实行微量营养素监测并及时补充对改善恶性肿瘤患者预后及生存质量具有重要意义。
目前,国内微量营养素监测及补充更多关注于特殊人群(孕妇、儿童、老年人等)[8],对于恶性肿瘤患者微量营养素的监测及补充尚未引起重视。因微量营养素缺乏早期临床表现不典型、与临床常用的营养风险筛查相关性弱[9]、过量补充有中毒风险等,临床亟需相关指南或共识对于恶性肿瘤患者微量营养素缺乏的监测和补充进行指导。欧洲肠外肠内营养学会[1](European Society for Clinical Nutrition and Metabolism,ESPEN)、美国肠外肠内营养学会[10](American Society for Parenteral and Enteral Nutrition,ASPEN)、中华医学会肠外肠内营养学分会[7](Chinese Society for Parenteral and Enteral Nutritional,CSPEN)等针对微量营养素的补充虽有推荐,但尚不能充分解决恶性肿瘤患者微量营养素缺乏及补充在实际临床应用中的问题。本共识总结了当前国内外与恶性肿瘤患者微量营养素补充相关的循证医学证据,结合临床实践经验,旨在揭示微量营养素在肿瘤治疗中的重要作用,引起肿瘤领域广大工作者的重视,为临床实际应用提供指导和参考意见。
1 人体微量营养素的定义
微量营养素是人体中需要量较少,但维持健康不可或缺的必需物质,包括微量元素和维生素[11]。微量元素指人体内含量小于体重0.01%的矿物质,是维持正常生理功能和生化代谢等生命活动的重要元素。微量元素包括铁、碘、锌、铜、硒等数十种,其中维持生命健康的必需微量元素有20余种。联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)、国际原子能机构(International Atomic Energy Agency,IAEA)、世界卫生组织(World Health Organization,WHO)专家委员会将“必需微量元素”分为三类:①人体必需的微量元素,包括铁、碘、锌、硒、铜、铬、钼、钴8种;②人体可能必需的微量元素,包括锰、硼、镍、钒、硅5种;③具有潜在毒性,但低剂量时可能对人体具有必需功能的微量元素,包括氟、砷、锂、锡、铅、镉、汞、铝8种。维生素是人体必需从食物中获取的一类有机物,参与机体的各种生化及代谢反应,分为脂溶性和水溶性两大类,脂溶性维生素指不溶于水,可溶于脂肪、非极性溶剂(如苯、乙醚及氯仿等)或极性较弱的乙醇等溶剂的一类维生素,包括维生素A、维生素D、维生素E和维生素K。水溶性维生素指能在水中溶解的一组维生素,是构成辅酶或辅基的重要成分,包括维生素B1(硫胺素)、维生素B2(核黄素)、烟酸(烟酰胺)、维生素B6(吡哆醇)、叶酸、维生素B12(氰钴胺素)、泛酸、生物素、胆碱、维生素C。
2 微量营养素缺乏对恶性肿瘤的影响
多项研究报道,铁、锌、硒、锰等微量元素在肿瘤患者血清中含量降低。微量元素铁缺乏与多种恶性肿瘤发生发展相关,包括结直肠癌(52.2%)、胰腺癌(63.2%)、肺癌(51.3%)、食管癌、泌尿生殖系肿瘤、乳腺癌、妇科肿瘤、睾丸癌、血液系统恶性肿瘤等[12]。大量证据表明,锌缺乏是恶性肿瘤的普遍特征,与食管癌、乳腺癌、肝癌、肺癌、宫颈癌、结直肠癌、前列腺癌、胰胆管癌等发生相关[13]。较低的血清硒浓度与较高的前列腺癌风险相关[14]。此外,一项荟萃分析结果显示,补充硒与较低的肿瘤发病率(OR=0.72)和较低的肿瘤死亡率(OR=0.76)相关,降低胃癌、结直肠癌、肺癌、乳腺癌、膀胱癌和前列腺癌等发生风险[15]。其他微量元素如锰等在恶性肿瘤中的缺乏亦有少量报道[16]。我国一项超过13万人的前瞻性队列研究表明,与未患肝癌队列相比,肝癌患者饮食中锰含量较低,膳食中较低的锰摄入与肝癌的发生显著相关[17]。
肿瘤患者中普遍存在维生素缺乏现象,程度各异[18]。维生素D缺乏发生于多种恶性肿瘤中,并与疾病进展相关。一项基于前瞻性队列研究的荟萃分析显示,较高的25-羟维生素D浓度与较低的肿瘤发病率和死亡率相关[19]。维生素D缺乏的乳腺癌及结直肠癌死亡率显著增加[20]。血浆25-羟基维生素D缺乏,可导致Ⅲ期结直肠癌的复发率增加、生存率降低[21]。维生素B12浓度低的人群,非贲门胃腺癌的患病风险增加[22]。血浆维生素A、维生素D、维生素E浓度降低与膀胱癌的发生相关[23]。维生素C缺乏在晚期恶性肿瘤患者中很常见,血浆维生素C浓度低的患者生存期较短[24]。此外,在儿童肿瘤患者中,分别存在维生素B12(39.1%)、叶酸(16.6%)、锌(32.3%)、硒(7.3%)、铜(2.2%)、铁(43.2%)的缺乏,且硒、锌、维生素B12及同时存在3种以上微量营养素缺乏均预示不良临床结局[25]。
3 补充微量营养素在恶性肿瘤治疗中的作用
随着微量营养素研究的不断深入,其在抗肿瘤治疗方面的积极作用被揭示。补充微量营养素可改善患者生存预后[26],提高对放疗、化疗以及免疫治疗的疗效[27-29]。此外,在抗肿瘤治疗期间适量服用微量营养素,可提高机体免疫力、减轻不良反应[30]。
3.1 微量元素
3.1.1 硒
硒从食物中摄取并以硒代半胱氨酸和硒蛋白的天然有机形式存在于人体中,参与细胞的抗氧化防御反应和维持细胞内氧化还原状态以维持细胞活力。硒联合化疗可显著提高霍奇金淋巴瘤化疗患者的缓解率,延长中位生存期[26]。多中心Ⅲ期临床研究显示,围放疗期补硒,可有效减少硒缺乏妇科肿瘤患者放疗引起的腹泻次数和严重程度[30]。同时,补硒对甲状腺癌患者的唾液腺损伤及头颈部肿瘤放疗患者早期味觉改变、放疗后吞咽困难和淋巴水肿均有显著改善意义[31-33]。卵巢癌患者在化疗的同时给予硒,血液毒性显著降低,脱发明显减少[34]。在妇科肿瘤放疗的同时服用硒可使≥2级的放疗相关腹泻的发生率从44.5%显著降低到20.5%(P=0.04)[35]。
3.1.2 锌
锌是细胞内300多种酶的辅助因子,在细胞膜修复、氧化应激、炎症与免疫防御等多个环节中起到关键调控作用。证据显示,对Ⅲ期或Ⅳ期鼻咽癌同期放化疗患者,补充锌可降低肿瘤局部复发,提高治疗疗效[27]。Rambod M等[36]发现补充锌显著降低白血病化疗患者口腔黏膜炎发生率和严重程度。头颈部肿瘤放疗患者补锌治疗可显著减少并减轻放射性口腔黏膜炎的发生及严重程度[37]。国际癌症支持治疗协会和国际口腔肿瘤学会(Multinational Association of Supportive Care in Cancer and International Society of Oral Oncology,MASCC/ISOO)临床实践指南专家组建议,在接受放疗或放化疗的口腔癌患者中,口服补锌可能对预防口腔黏膜炎有益[38]。
3.1.3 铁
铁是一种重要的微量元素,在线粒体的氧代谢、氧摄取、电子传递、能量代谢、肌肉功能和造血中起着至关重要的作用。证据显示,细胞内铁增加可诱导肿瘤细胞死亡,从而增强化疗或放疗疗效[39-40],补充铁剂对放化疗的增敏作用有待进一步临床研究证据支持。肿瘤相关性贫血是肿瘤患者的常见不良反应,补充铁剂是治疗肿瘤相关性贫血的重要方式,既能有效改善贫血症状,又能显著提高患者生活质量[41]。
3.2 维生素
3.2.1 维生素B1
维生素B1缺乏被证实是肿瘤患者再喂养综合征的一种常见表现,可导致与神经系统功能相关的韦尼克脑病[42]。维生素B1剂量不足可能导致发病率和死亡率显著增加[43]。对于再喂养综合征高危患者,推荐在营养治疗前预防性补充维生素B1[42]。补充维生素B1是治疗韦尼克脑病的重要手段,及时补充维生素B1可有效改善患者预后[44-45]。
3.2.2 维生素B2
维生素B2在体内是黄酶类辅基的重要构成部分,黄酶在生物氧化还原过程中传递氢。荟萃分析结果显示,补充维生素B2可降低结直肠癌发生风险[46]。放射性口腔黏膜炎的发生与维生素B2摄入减少或代谢障碍密切相关。前瞻性临床研究结果显示,维生素B2联合康复新液治疗,可有效降低Ⅲ/Ⅳ级放射性口腔黏膜炎的发生率,缩短炎症持续时间[47]。
3.2.3 烟酸
烟酸(又称维生素B3)在体内以烟酰胺的形式存在,烟酰胺是辅酶Ⅰ和辅酶Ⅱ的组成成分,是线粒体代谢和氧化还原反应的关键调节因子,调节线粒体稳态及组织功能。最新研究发现,烟酸能有效纠正组织NAD+水平,改善线粒体代谢,缓解肿瘤和化疗引起的恶液质[48]。
3.2.4 维生素B6
维生素B6参与机体营养物质代谢,促进新陈代谢。观察性研究队列显示,膳食摄入维生素B6与较低的结直肠癌的发生和区域转移风险相关[49]。此外,维生素B6有助于缓解卡培他滨引起的手足综合征,减轻对患者日常生活的影响,从而改善患者的生存质量[50]。
3.2.5 叶酸
叶酸是体内生化反应中一碳单位转移酶系的辅酶,对细胞分裂和组织生长具有重要作用。对不能切除的大肝癌患者,亚叶酸作为一种含叶酸的药物载体,联合其他化疗药物的肝动脉灌注化疗提高了患者总生存率[29]。叶酸和维生素B12共同促进骨髓红细胞生成,叶酸不足常导致肿瘤相关性贫血的发生[41]。Ⅲ期临床研究结果显示,培美曲塞联合顺铂治疗恶性胸膜间皮瘤时,补充叶酸和维生素B12可显著降低不良反应[51]。
3.2.6 维生素B12
维生素B12参与人体诸多重要的生化反应,如DNA合成、红细胞形成、神经传导等。缺乏维生素B12可能会导致贫血,以及神经系统及消化系统等问题。补充维生素B12可有效改善化疗引起的周围神经病变[52]。
3.2.7 维生素C
维生素C作为一种抗氧化剂具有低毒、低成本的优点。大剂量维生素C可通过调节氧化应激、表观遗传,增强免疫功能等发挥抗肿瘤作用[53]。在结直肠癌、胰腺癌、肺癌及血液肿瘤中,静脉注射大剂量维生素C联合治疗相较于单纯化疗,延长了肿瘤患者的无进展生存期和总生存期[54-55],同时具有较好的耐受性。此外,静脉注射大剂量维生素C可缓解多种肿瘤化疗相关的症状,如疲劳、失眠、食欲缺乏、恶心和疼痛等[56-59]。
3.2.8 维生素D
维生素D是一种具有多种作用机理的类固醇激素前体,具有调控细胞分化和凋亡,抑制肿瘤细胞增殖和血管生成,以及抗炎和免疫调节的特性。一项荟萃分析结果显示,虽然维生素D补充剂并不能降低肿瘤的总发生率,但却显著降低肿瘤总死亡率[60]。维生素D可降低p53免疫反应亚组消化道肿瘤患者的复发或死亡风险,也可提高晚期黑色素瘤患者的免疫治疗疗效,延长无进展生存期[28,61]。此外,补充维生素D3可显著改善血清25-羟维生素D浓度,并降低乳腺癌中来曲唑治疗引起的关节痛[62]。维生素D治疗12周可减少维生素D缺乏肿瘤患者的阿片类药物使用和疲劳[63]。
3.2.9 维生素E
维生素E是有效的抗氧化剂,具有清除过氧化脂质自由基的活性作用。维生素(包括维生素C、维生素E)补充可降低幽门螺杆菌阳性胃癌患者的死亡率,在补充约8年后,其累积保护作用变得显著[64]。随机对照临床研究显示,口服补充维生素E可有效降低化疗引起的周围神经损伤,发生率从73.3%下降至25%(P=0.019)[65]。补充维生素E可有效缓解儿童肿瘤化疗相关口腔黏膜炎的程度[66]。
其他微量元素、维生素及其衍生物在肿瘤治疗中的正面影响还需进一步的临床研究来揭示。科学补充微量营养素对改善恶性肿瘤患者治疗耐受性和预后至关重要,可作为肿瘤治疗过程中的支持疗法。
4 恶性肿瘤患者微量营养素缺乏的评价
大多数微量营养素缺乏与常规营养风险筛查和营养评估相关性弱,仅凭临床症状难以判断,应成立多学科营养支持小组(nutritional support team,NST)。NST由肿瘤科医师、营养师、营养专科护士等人员组成,根据肿瘤患者的疾病史、膳食摄入情况、体格检查、实验室指标等进行规范化的早期筛查、评价及治疗。
4.1 评价方法
4.1.1 一般情况
(1)一般信息:了解患者性别、年龄、职业、常住地址等。
(2)疾病史和膳食史:①询问患者既往病史、用药情况及生活习惯;②了解患者近1~3个月的膳食摄入情况;③了解患者每日户外活动时长。
4.1.2 体格检查微量营养素缺乏临床表现不一,参照《中国居民膳食营养素参考摄入量(2023版)》[11]进行总结(表1)。

4.1.3 实验室检测
目前针对血液样品中微量元素的测定方法,主要有原子吸收光谱法(atomic absorption spectroscopy,AAS)、原子荧光光谱法(atomic fluorescence spectrometry,AFS)、电感耦合等离子体发射光谱法(inductively coupled plasma optical emission spectrometer,ICP-OES)和电感耦合等离子体质谱法(inductively coupled plasma-mass spectrometry,ICP-MS)等。考虑到血液样品量小,且微量元素含量低,推荐使用ICP-MS针对多种微量元素进行高效、快速、灵敏分析[67]。
针对血液样品中维生素的测定方法主要有免疫学分析法、电化学分析法、液相色谱-串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)等。但因各种维生素,尤其是水溶性维生素水平受饮食影响短期波动较大,在体内的存在形式复杂,血液检测结果和患者表现及病理生理改变并不完全具有相关性,建议参考《中国营养科学全书》(第2版)[68]各类维生素的测定与评价方式结合患者情况进行选择(表2)。


4.2 评价注意事项
微量营养素缺乏存在“假阴性”,当发生全身炎症反应时,血液中的浓度可能低于其在人体内的实际水平。铜、硒、锌、维生素A、维生素B6、维生素C等微量营养素的体内水平会受到炎症的影响[69]。炎症反应会诱导血浆内的微量营养素从体循环重新分布至各器官,导致大多数微量营养素水平较低,因此较低的血液浓度不等同于缺乏。
对于长期肠外营养的患者,根据ESPEN家庭肠外营养指南建议,每12个月至少进行1次微量营养素的追踪评估[70]。
专家推荐:
推荐意见1:推荐成立NST,从肿瘤治疗初期开始关注患者微量营养素水平,进行规范化的早期筛查、评价及治疗。(证据等级:A,推荐强度:强)
推荐意见2:推荐使用ICP-MS检测血液样本,实现微量元素的高效、快速、灵敏分析。(证据等级:B,推荐强度:强)
推荐意见3:各种维生素在体内的存在形式复杂,检测结果的解读应密切结合临床,综合判断。(证据等级:A,推荐强度:强)
5 恶性肿瘤患者微量营养素的补充
5.1 补充原则
在临床诊疗中,出于安全和实际情况考虑,根据《中国临床肿瘤学会(CSCO)恶性肿瘤患者营养支持与治疗指南解读》[71]每日需要的微量营养素应参考WHO/FAO推荐以及国家和国际营养学会的营养素推荐每日摄入量(reference nutrient intake,RNI)或适宜摄入量(adequate intake,AI)进行微量营养素的补充(表3)。密切观察患者的临床表现,监测所补充的微量营养素是否处于安全范围内,防止微量营养素缺乏的同时避免过量导致相关毒性反应。应从恶性肿瘤患者治疗初期开始全程关注微量营养素水平,并根据风险评估来制定补充方案。目前,加拿大、澳大利亚,以及北欧等国家对微量营养素的风险等级进行划分并制定摄入风险评估,我国目前参照北欧划分模式,以可耐受最高摄入量(tolerable upper intake level,UL)和RNI的比值,即UL/RNI来确定风险等级[72]:
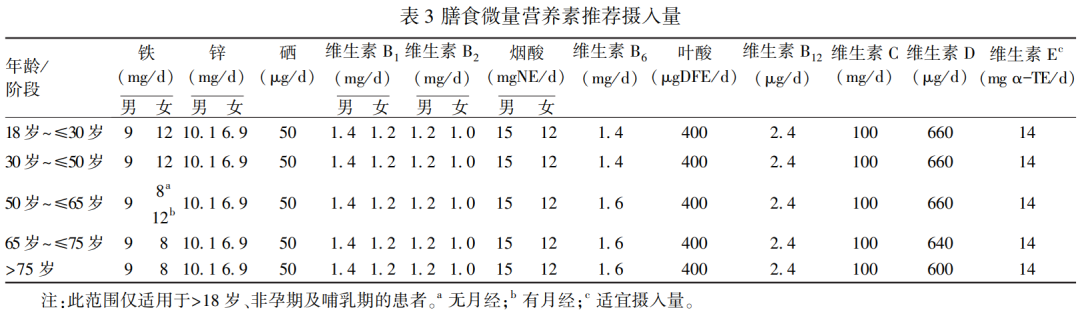
A级:UL/RNI<5的营养素,表示安全范围间距较小,如维生素A、烟酸、叶酸、维生素D、铁、锌、硒、氟、锰等。建议该类营养素在补充时应该谨慎对待。
B级:UL/RNI在5~100之间的营养素,表明其安全范围居中,如维生素B6、烟酰胺、维生素C、维生素E、钼、铜等。建议该类物质通过饮食强化时需要考虑与膳食中其他营养成分的相互作用和某些不良反应。
C级:未设定UL或UL/RNI>100的营养素,表明超过推荐摄入量的100倍也未发现不良反应,也未观察到与其他成分的互相作用,如维生素B1、维生素B2、维生素B12、维生素K、泛酸、生物素等。
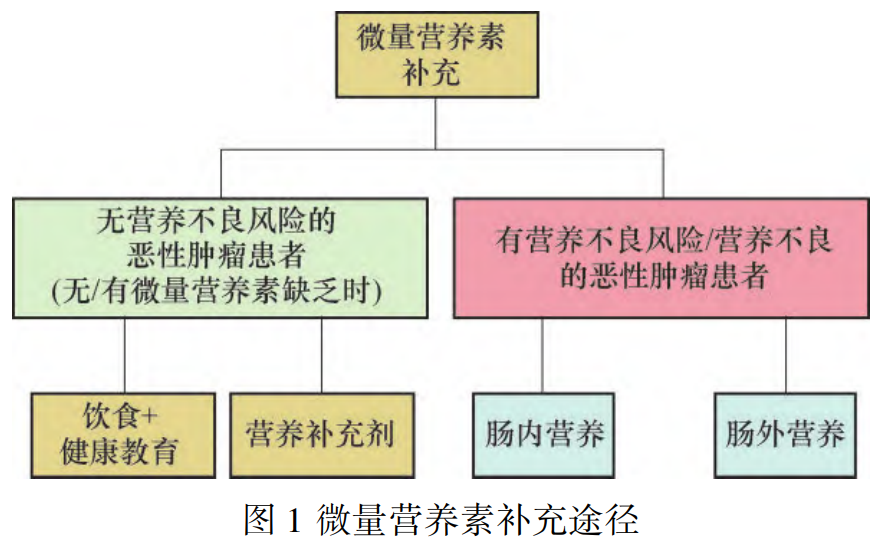
5.2 补充途径根据各国微量营养素缺乏的防治经验,膳食多样化、食品强化以及营养素补充剂的应用是改善微量营养素缺乏的主要措施,其中强化食品的相关研究尚未涉及恶性肿瘤患者[73]。微量营养素补充途径可根据恶性肿瘤患者情况分为“三类四种”,见图1。尚无营养不良风险的恶性肿瘤患者且无微量营养素缺乏,以饮食+健康教育为主,同时监测微量营养素水平,预防缺乏;伴有微量营养素缺乏时,可通过营养补充剂进行改善;具有营养不良风险/营养不良的恶性肿瘤患者,应尽早开展包括微量营养素补充在内的综合营养治疗措施。
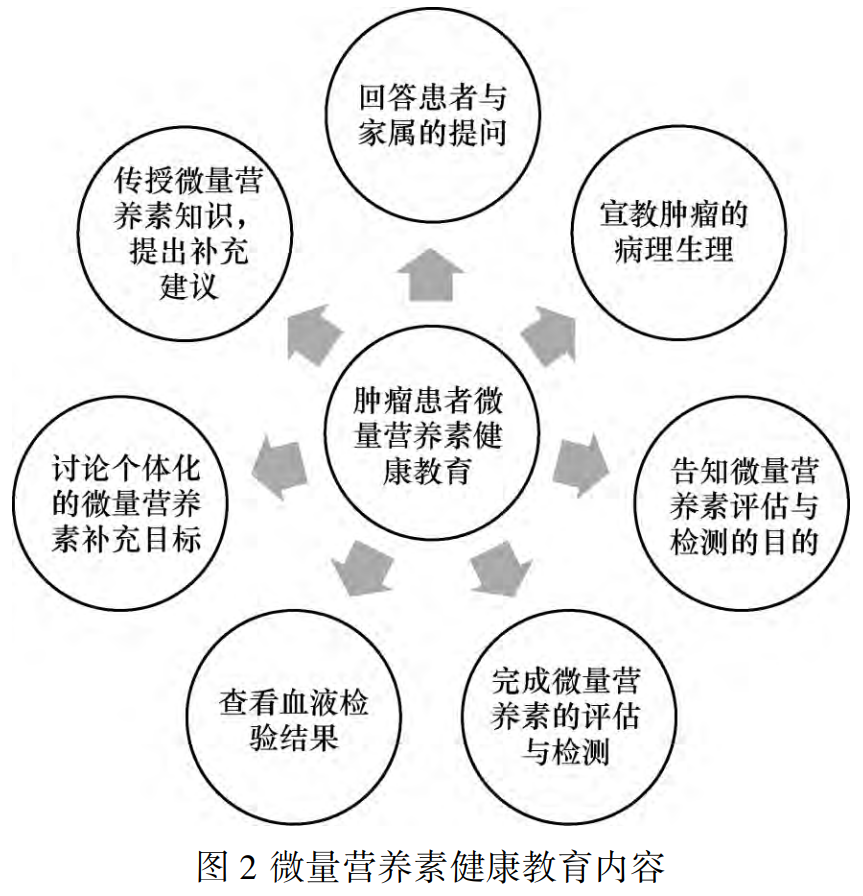
5.2.1 饮食+健康教育饮食+健康教育是所有恶性肿瘤患者的预防微量营养素缺乏的首选方式。鼓励患者饮食多样化,破除常见营养误区,如:海鲜是“发物”影响伤口愈合、不吃动物内脏等。获得全面适宜的微量营养素。《中国食物成分标准版》[74]介绍了常见食物中的微量营养素含量。健康教育包括微量营养素相关知识咨询、饮食指导及饮食调整等(图2)。患者膳食摄入情况可通过膳食多样化评分进行评估。
膳食多样化评分(dietary diversification score,DDS)是评价膳食多样化最常用的方法[75],将食物分成若干类,根据食物类别进行计数,目前更多学者认为9类(DDS9)效率最高,更为推荐。DDS9根据中国居民平衡膳食宝塔,将食物分为谷类、蔬菜类、水果类、畜肉类、鱼虾类、蛋类、奶类及奶制品、豆类及豆制品、油脂类九大类。DDS通过每个研究对象累计3d内消费的食物种类总数而得出,每消费一类食物计1分,消费同一类食物不重复计分。最高为9分,不计食物的消费频次和数量。DDS分值越高表明食物多样化的程度越高,可分为3个等级:1~3分为不足,4~6分为适中,7~9分为充足。患者通过均衡饮食摄入各种类型必需微量营养素时,不可盲目使用营养素补充剂。
5.2.2 营养补充剂
2005年我国发布了《营养素补充剂申报与审评规定(试行)》,将营养素补充剂定义为一种旨在补充维生素和矿物质,而不以提供能量为目的的制品。其主要功能是补充膳食中微量营养素的不足,从而预防营养缺乏,并降低罹患某些慢性退行性疾病的风险[76]。营养补充剂可分为单一型和复合型,主要产品包括:非处方类、保健类和其他各类营养素产品[77]。患者营养素摄入不足,或经临床表现、生化检测确认某种营养素缺乏或不足时,需由营养(医)师评估后,参照人体每日推荐摄入量,选择使用适宜的营养素补充剂[78]。
5.2.3 肠内营养
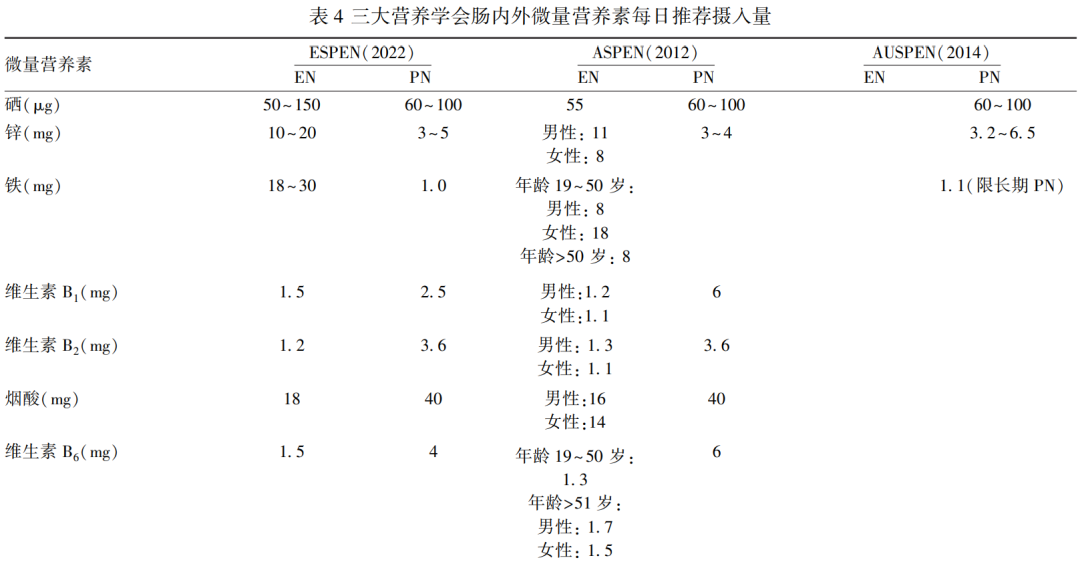
肠内营养(enteral nutrition,EN)特指通过消化道(包括口服、管饲)补充肠内营养制剂[79]。肠内营养制剂可按临床用途分为普通型与疾病适用型。肿瘤患者可选用针对性较强的肿瘤适用型。常规肠内营养制剂均配备适量微量营养素,为满足不同疾病需求,还设有组件型,如蛋白质组件、维生素组件、矿物质组件及益生菌组件等。临床应用时,需由营养支持小组结合患者综合情况进行选择,具体补充剂量见表4。特定某种微量营养素缺乏时,可单独额外补充[80]。

5.2.4 肠外营养
肠外营养(parenteral nutrition,PN)适用于无法通过口服和/或肠内途径满足其营养需求的患者。临床可选用的微量元素肠外营养制剂有:多种微量元素注射液(Ⅰ)、多种微量元素注射液(Ⅱ)。维生素制剂包括注射用水溶性维生素、注射用脂溶性维生素(Ⅰ)、注射用脂溶性维生素(Ⅱ)、注射用多种维生素(12)、注射用多种维生素(13)、注射用脂溶性维生素(Ⅱ)/注射用水溶性维生素组合包装等。肠外营养制剂属于静脉用药,其混合液的稳定性与相容性应尤为注意[81-82],具体补充剂量见表4。特定某种微量营养素缺乏时,可单独额外补充。
专家推荐:
推荐意见4:微量营养素的补充应参考WHO/FAO推荐以及美国肠内肠外营养学会、澳大利亚肠外肠内营养学会、欧洲肠外肠内营养学会的营养素推荐每日摄入量或适宜摄入量进行补充,避免超过最大可耐受摄入量,密切观察患者的临床表现,监测所补充微量营养素是否处于安全范围内。(证据等级:B,推荐强度:强)
推荐意见5:推荐参考北欧微量营养素风险等级划分标准,合理权衡微量营养素的摄入,以避免过量补充产生毒副作用。(证据等级:B,推荐强度:强)
推荐意见6:为预防微量营养素缺乏,恶性肿瘤患者应饮食多样化。膳食摄入微量营养素不足,经实验室检查或临床表现证实存在某类微量营养素缺乏或不足时,应由有资质的营养(医)师评估后使用微量营养素补充剂,首选口服或肠内补充。(证据等级:A,推荐强度:强)
6 小结恶性肿瘤是人类主要的健康问题,严重威胁人民身心健康、经济发展。营养治疗是肿瘤的基础治疗之一,作用重大。在临床诊疗中已不仅局限于满足患者的蛋白质、能量需求,应进一步满足微量营养素在内的全方位人体需求。微量营养素含量虽少,但参与机体多个重要生理过程。肿瘤患者可通过微量营养素的补充提高肿瘤治疗疗效、降低治疗不良反应,作为新兴的抗肿瘤疗法具有重大意义。由于微量营养素的摄入及治疗剂量,以及使用时限,目前还没有统一标准。还需要更多的研究来探求更为精准的补充剂量以避免微量营养素过量引发的毒性反应。但微量营养素在恶性肿瘤综合治疗中的作用应引起广大临床医学及营养学专家的高度重视。
文章来源:指南解读,转载自 肿瘤医学论坛
声明:本文仅供医疗卫生专业人士为了解资讯使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该信息被用于了解资讯以外的目的,平台及作者不承担相关责任。